22 Mai Comprendre le nouveau règlement Européen DM/DIV
FINDMED présent à l’atelier Medicen « comprendre le nouveau règlement Européen DM/DIV et anticiper son impact sur l’industrie du dispositif médical et du diagnostic in vitro »
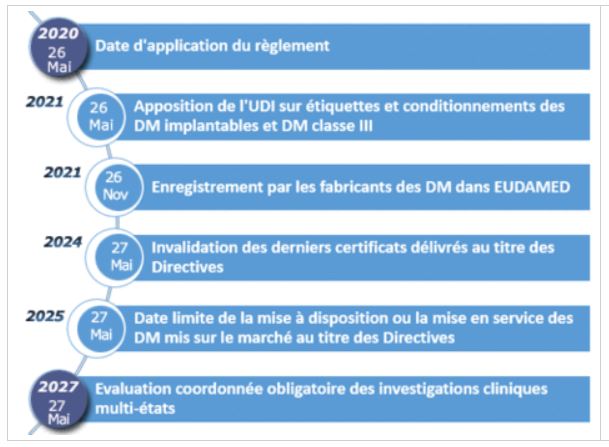
Le Pôle de compétitivité Medicen Paris Région, en association avec l’ANSM et le GMED, a organisé un atelier pour permettre de mieux appréhender le nouveau règlement européen des dispositifs médicaux et des dispositifs médicaux du diagnostic in vitro au sein de l’institut Carnot ICM. Le monde des dispositifs médicaux au sein de l’Union Européenne traverse une période importante de son histoire. Le processus de révision complète de la réglementation européenne relative aux dispositifs médicaux s’est achevé en 2017 pour laisser place en 2020 au Règlement (UE) 2017/745 commun pour l’ensemble des États membres.
Le passage de la directive appliquée depuis près de 25 ans à un nouveau règlement en 2020 n’est pas simple. Cette période de transition nécessite la rigueur et l’anticipation de tous les protagonistes du secteur. Les Organismes Notifiés (O.N) ont été audités en 2018 et leur certification sera bientôt effective. Les fabricants pourront commencer à être notifié via le règlement à partir d’Août 2019 si le planning établi par le Notified Body Operations Group (NBOG) est respecté.